「混合診療」拡大要求
 ■規制緩和派の「混合診療」拡大要求が矛盾を広げる
■規制緩和派の「混合診療」拡大要求が矛盾を広げる
より有効な病気の治療法を開発するために人の体を使って行う臨床研究では、研究に参加する被験者の人権の保護とデータの信頼性確保が欠かせない。日本では過去、被験者への説明なしの試験薬投与や倫理審査委員会の機能不全など、臨床研究をめぐるさまざまな問題が表面化したが、根本的な対策がとられてこなかった。その結果、高血圧症治療薬ディオバンの臨床研究不正が2013年に明るみに出て、日本の臨床研究のずさんさが国内外に広く印象づけられた。臨床研究の不祥事が絶えないのはなぜか――。この連載ではその背景をさぐる。第1部では、生命倫理研究者の橳島次郎氏と朝日新聞の出河雅彦記者の対談を通して問題の核心に迫る。第1部の最終回となる第5回では、未承認薬などを用いる保険外診療と保険診療との併用を例外的に認める制度の改革と問題点について考える。

出河 今回は、いわゆる「混合診療」と臨床研究の関係について話し合ってみたいと思います。混合診療は、公的医療保険が適用される「保険診療」と、保険が適用されない「保険外診療」を1人の患者に対して併用することで、厚生労働省が原則禁止にしています。未承認の薬や保険適用外の医療技術を用いる診療をした場合、それら未承認薬や医療技術の費用を公的医療保険に請求できないだけでなく、診察や検査、入院など、本来であれば保険が適用される診療費用についても保険請求ができなくなります。混合診療が原則禁止されている理由は、安全性や有効性が確立していない診療に、国民全体の負担で運営されている公的医療保険のお金が費やされることや、未確立の診療で患者が不当に高い負担を求められたり、安全が脅かされたりすることを防ぐため、とされています。ただし、一定の条件を満たした医療機関で行われる先進医療のほか、差額ベッドや歯科材料、紹介状なしに大病院を受診した際の初診料などについては、厚生労働省が保険診療と保険外診療の併用を認めています。
例外的に保険診療と保険外診療の併用を認める「特定療養費制度」は1984年に健康保険法に位置付けられた。この制度の下で併用が認められたのは、大学病院などでの「高度先進医療」と、「選定療養」で、後者の対象は当初、差額ベッドと歯科材料のみだったが、その後、予約診療や、時間外診療、紹介状なしでの200床以上の病院の初診、再診などが追加され、保険・保険外の併用を認める範囲は少しずつ広がってきた。
特定療養費制度はその後、「聖域なき構造改革」を掲げた小泉純一郎内閣時代の混合診療解禁をめぐる論争をきっかけに大きく見直される。2004年8月に、総理大臣の諮問機関である規制改革・民間開放推進会議(当時)が、「一定水準以上の医療機関では、保険で使用が認められていない新しい検査法、薬、治療法を用いた混合診療を医療機関の判断で行うことを包括的に認めるべきだ」とする意見をまとめ、公表した。混合診療の原則禁止によって、海外では広く認められているのに日本では保険がきかない新しい医療技術・サービスに対する医師の積極的取り組みを阻害し、患者の受診機会を狭め、医療サービスの質の向上を妨げている、というのが、規制改革・民間開放推進会議の論理だった。
一定水準以上の医療機関に限って混合診療の全面解禁を求めた規制改革・民間開放推進会議の提言に対しては、厚生労働省や多くの医療関係団体が反対し、混合診療の導入に反対する請願も衆参両院の本会議で採択された。最終的に、同会議が求めた「全面解禁」は実現しなかったが、2004年12月にまとまった、厚生労働、規制改革担当両大臣の「いわゆる混合診療問題に係る基本的合意」によって、一定のルールの下に保険診療と保険外診療の併用を認め、保険外診療の保険導入手続きを明確化することになった。
両大臣合意に基づき、健康保険法が2006年に改正され、特定療養費制度に代わって、新たに「保険外併用療養費制度」が同年10月に施行された。この制度では、保険診療と保険外診療の併用を例外的に認めるものを、「評価療養」と「選定療養」の二つに区分した。評価療養は「保険導入のための評価を行う」もの、選定療養は「保険導入を前提としない」ものと、それぞれ定義された。評価療養には、先進医療(従来の「高度先進医療」と「必ずしも高度でない先進医療」を統合)などが、選定療養には、差額ベッドや歯科材料、予約・時間外診療、大病院の初・再診、180日以上の入院などが含まれる。
出河 「臨床研究の管理」の観点から保険外併用療養費制度を見ると、さまざまな問題点がありますので、そのことを論じてみたいと思います。その場合の主たる対象は、評価療養の一つと位置づけられている「先進医療」の取り扱いです。先進医療には、未承認薬・医療機器の使用や医薬品・医療機器の適応外使用を伴うものが含まれるからです。

先進医療は、医療機関からの申請に基づき、厚生労働省の専門家会議(現・先進医療会議)が医療技術ごとにそれを実施できる医療機関の要件を定め、その要件を満たす医療機関での保険・保険外診療の併用を認めるものです。実施医療機関は国への実績報告が求められ、2年に1回行われる診療報酬改定に合わせて、有効性、安全性などの観点から、保険を適用するかどうかが先進医療会議で検討され、「保険導入が妥当」と判断された医療技術は、中央社会保険医療協議会での議論を経て保険診療に取り込まれていく、という流れになっています。逆に、有効性、安全性が確認できないとして先進医療の対象から外されるものもありますし、先進医療として継続されるものもあります。
そもそも先進医療とはどのようなものなのか。厚生労働省が2016年3月に出した局長通知には「基本的な考え方」として、「国民の安全性を確保し、患者負担の増大を防止するといった観点を踏まえつつ、国民の選択肢を広げ、利便性を向上するという観点」から、「一定の施設基準」や「医療技術ごとの実施医療機関の要件」を定め、「保険診療との併用を認める」と記されています。
前述したように、先進医療には未承認薬・医療機器の使用や、医薬品・医療機器の適応外使用を伴うものが含まれていますが、医薬品医療機器法は適用されません。臨床研究として実施されるものは、いまのところ行政指針に基づくことが求められているだけです。先進医療は、研究なのか診療なのか、その位置付けも不明確です。保険外併用療養費制度は健康保険法に基づく制度ですが、そもそも健康保険法は、「疾病、負傷若しくは死亡又は出産に関して保険給付を行い、もって国民の生活の安定と福祉の向上に寄与することを目的とする」法律です。この制度をどう見たらよいでしょうか?
橳島 次郎(ぬでしま・じろう)
1960年横浜生まれ。1988年東京大学大学院社会学研究科博士課程修了、社会学博士。三菱化学生命科学研究所 社会生命科学研究室長などを経て、2007年から生命倫理政策研究会共同代表、2015年から慶應義塾大学医学部非常勤講師。専門は生命倫理。
著書に、『生命の研究はどこまで自由か』(岩波書店)、『生命科学の欲望と倫理』(青土社)、『これからの死に方』(平凡社新書)、『移植医療』(出河雅彦と共著、岩波新書)など。
橳島 先進医療は、健康保険が適用されるまでの「待合室」だとされてきました。実験段階の薬物や医療機器、技術が通常医療の段階に移行するまでは、「実験段階→試行段階→受容段階→通常医療段階」と進みます。実験と医療の間の二段階は、英語でいうとわかりやすいのですが、「questionable」と「acceptable」です。試行段階はまだクエスチョン・マーク「?」がつく段階。いけるかな、どうかなという段階で、専門医の意見もまだ一致していない段階です。それが「受容段階」まで進んではじめて、もう受け入れ可能かな、となり、専門医の評価も定まって、普及して行く段階に入る。「実験」「試行」は研究で保険は適用されない。「受容」になって部分的に、「通常医療」になって全面的に保険が適用される。それが筋です。ですから先進医療は、保険が部分的に適用されるのだから、「受容段階」にあるものでなければならない。しかし実際には、まだ試行段階、「?」の段階であるようなものが紛れ込んでいる節がある。試行から受容に進んだとの医学的評価がすべてのケースできちんと行われているか、厳密な検証が必要だと思います。
出河 先進医療は、実施状況の国への定期報告や、重篤な有害事象が発生した際の国への報告が実施医療機関に課されており、国が厳格に管理しているように見えますが、被験者保護の観点からは問題もあります。それは、先進医療として国に保険併用の承認を申請する前段階で医療機関が行う臨床研究の管理が、医療機関内の倫理審査委員会に委ねられていることです。保険併用の承認を国に求める際には、当該医療技術を一定件数、患者で試し、その実施結果を添えて申請することが前提になっているからです。つまり、初めて患者に対して実施する際の倫理審査は施設内の倫理審査委員会が担当するわけですが、倫理審査委員会が十分にチェック機能を果たしているとは言えません。
また、先進医療の対象になった後に重大なルール違反が明らかになった事例もあります。例えば、金沢大学附属病院などで行われていた、悪性骨軟部腫瘍に対して抗がん剤とカフェインを併用する療法(以下、カフェイン併用化学療法)は2003年に当時の高度先進医療として認められたものですが、研究グループが、被験者の適格基準を満たさない患者や、臨床試験としての症例登録期間の終了後に新たに受け入れた患者に対して、症例登録を行わずに実施したほか、臨床試験の症例登録が行われた患者(被験者)についても倫理審査委員会の承認を得ずに被験者の適格基準を変更していたことなどが明るみに出て、2014年に先進医療から削除されました。2010年には、金沢大学病院でカフェイン併用化学療法を受けた16歳の女性患者が死亡し、整形外科教授ら3人の医師が業務上過失致死の疑いで石川県警から書類送検されました(起訴はされず)。
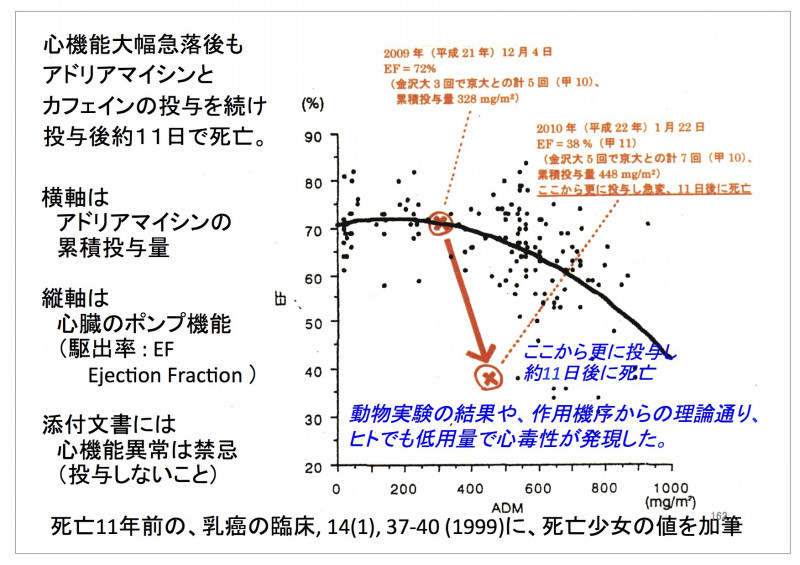
橳島 医療の現場に、法令の管理のない臨床試験が軽く見られている土壌があるなかで、先進医療への申請のために実施されたケースがどこまで「研究」としてきちんと管理されてきたのかも、検証する必要がありますね。治験とそれ以外の臨床試験を区別するという日本だけの仕分けは、大きなリスクを孕んでいることがわかります。
出河 厚生労働省は両大臣合意に伴って高度先進医療制度を見直すまで、薬事法(現・医薬品医療機器法)に基づく承認を得ていない薬物や医療機器を高度先進医療の中で用いることを認めていました。本来、そうした未承認薬・医療機器は、薬事法に基づいて厳格に管理される治験を行い、その有効性と安全性を評価すべきですが、厚生労働省にはその意識が希薄だったわけです。
厚生労働省は保険併用を認める範囲を、必ずしも高度でない先進医療にまで広げるにあたって、薬事法上の未承認、適応外使用に該当する薬物や医療機器を用いた医療技術は対象に含めないことにした。その結果、それまでの高度先進医療で認められていた、未承認、適応外使用に該当する薬物や医療機器を用いた医療技術(18種類)の扱いが焦点となった。厚生労働省は、これら医療技術について、①薬事法上の承認申請、②薬事承認に向けての治験、③一定の基準を満たす「臨床的な使用確認試験」のいずれかを行うよう求め、2008年3月末までに①~③のいずれかを実施していない技術については、原則として先進医療の承認を取り消すことにした。「臨床的な使用確認試験」は、すでに国内で薬事承認を得ている医療機器などを適応外で使用して行う先進医療を対象としたもので、臨床データの収集が確実にできる体制が整っているなど、一定の条件を満たした医療機関においては、薬事法に基づく治験を行わなくても引き続き先進医療として保険併用を認めることにした。
出河 厚生労働省は「臨床的な使用確認試験」の対象とすべき技術の要件や個別医療機関での実施の可否などを審議する検討会を2007年6月に設けたのですが、2008年3月末までとされた経過期間が終了するに当たって、既存の18技術だけでなく、薬事法上の未承認や適応外使用に該当する薬物や医療機器を先進医療の中で使用できるようにしました。それが2008年4月に新たに導入された「高度医療評価制度」です。厚生労働省医政局長名の2008年3月31日付都道府県知事宛通知「高度医療に係る申請等の取扱い及び実施上の留意事項について」には、高度医療評価制度を創設する趣旨が次のように書かれています。
薬事法の承認等が得られていない医薬品・医療機器の使用を伴う先進的な医療技術については、一般的な治療法ではないなどの理由から原則として保険との併用が認められていないが、医学医療の高度化やこれらの医療技術を安全かつ低い負担で受けたいという患者のニーズ等に対応するため、今般、これらの医療技術のうち、一定の要件の下に行われるものについて、当該医療技術を「高度医療」として認め、先進医療の一類型として保険診療と併用できることとし、薬事法による申請等に繫がる科学的評価可能なデータ収集の迅速化を図ることを目的として、高度医療評価制度を創設することとする。
出河 ちなみに、前述したカフェイン併用化学療法は未承認・適応外薬を使用する高度先進医療として実施され、高度医療評価制度導入後は引き続き、その対象として保険併用が認められていたものです。
高度医療評価制度の導入は、医薬品・医療機器の製造販売承認申請データを収集するために行われる治験と、それ以外の臨床研究(試験)で規制の方式が異なるという、「二重基準」を放置したまま、その矛盾をさらに拡大する方向に進めるものであったと思います。患者と公的医療保険の負担で臨床研究が実施できるので、研究者にとっては好都合かもしれませんが、未承認の薬物などを使用するものであるにもかかわらず、薬事法の規制を受けないので、患者の安全がきちんと確保されるのかという懸念に加え、収集されたデータだけでは薬事承認申請はできず、新たに治験をやり直さなければならないという問題もあります。高度医療評価制度の導入によって、すでに薬事法の承認を受けている医薬品、医療機器を承認外の効能・効果、用法・用量で使用する場合だけでなく、大学の研究者が発見し、世界中どこの国でもまだ承認を受けていない薬の候補物質を用いた臨床試験まで保険併用が認められることになりました。
厚生労働省は2012年10月以降、先進医療について、単純に未承認薬・機器を用いるか否かで区分けすることをやめ、新たに「先進医療A」、「先進医療B」という二つの区分を設けることにした。先進医療Aに含まれるのは、
未承認・適応外の薬・機器を用いない医療技術、
未承認・適応外の体外診断薬などを使用するが、当該検査薬などの使用による人体への影響が極めて小さい医療技術
で、先進医療Bに含まれるのは、
未承認・適応外の薬・機器を用いる医療技術、
未承認・適応外の薬・機器は用いないが、当該医療技術の安全性、有効性に照らして、特に重点的な観察・評価が必要と判断されるもの、
である。この見直しに伴い、先進医療専門家会議は先進医療会議へ、高度医療評価会議は先進医療技術審査部会へと、それぞれ改称され、先進医療Bについては先進医療技術審査部会で技術的な妥当性や試験実施計画の審査を行うことになった。
先進医療Aでは、ある医療技術の保険併用について医療機関から申請があり、厚生労働省が実施を認める施設基準を設けると、その後は施設基準を満たす他の医療機関でも地方厚生局に届ければ、保険併用が認められる。一方、先進医療Bでは、施設基準が設けられた後、最初に申請した医療機関以外の施設が実施を希望する場合には申請医療機関を中心とする多施設共同研究として行うことが求められる。
2012年10月以前から先進医療として認められ、未承認・適応外の医薬品、医療機器を用いない技術の中には、施設内での倫理審査が不要とされたものもあったが、2012年10月の制度見直し以降は、先進医療A、Bを問わず、実施医療機関では倫理審査委員会の設置が必要になった。ただし、先進医療Aについては、「個別症例の治療方針を検討する医の倫理委員会などでも構わない」とされ、倫理審査委員会の開催頻度なども技術によって異なる。
先進医療の保険導入に向けた検討は、2年に1回の診療報酬改定時に行われる。検討対象となるのは、先進医療Aのすべての技術と、未承認・適応外の医薬品、医療機器を使わない先進医療Bのうち研究期間が終了して総括報告書が厚生労働省に提出された技術である。未承認・適応外の医薬品、医療機器を用いる先進医療Bの場合は、研究期間が終了してもそのまま保険導入とはならず、基本的には、改めて薬事承認を目指しての治験の実施が必要となる。
2017年9月1日現在で、先進医療Aの対象技術は36種類、実施医療機関はのべ1034施設、先進医療Bの対象技術は69種類、実施医療機関はのべ626施設。先進医療のうち未承認・適応外の医薬品、医療機器を用いる医療技術に関しては、来年4月施行の臨床研究法が適用される見込みだ。
出河 先進医療制度の見直しは、経済成長戦略の一環、具体的には画期的な医薬品、医療機器の開発の促進という国の政策目標に沿って進められています。そのような観点からすれば、先進医療の中で収集された臨床データは、薬や医療機器の薬事承認に活用されるべきという意見が出てきて当然ですが、先進医療B(旧高度医療)は、治験の具体的な実施手順を定めた法令に基づいて行われるものではありません。厚生労働省は2012年7月31日に出した医政、医薬食品(当時)、保険の3局長通知の中で、「治験に先立って実施される未承認医薬品や再生医療、個別化医療に係る先進医療の成果については、薬事戦略相談を活用することにより、薬事承認申請の効率化を可能とする」としています。薬事戦略相談は、薬や医療機器の審査を行う独立行政法人医薬品医療機器総合機構(PMDA)が、有望性の高い医薬品の候補物質などを発見した大学・研究機関、ベンチャー企業を主な対象に、必要な臨床試験・治験計画策定等に関する指導・助言を行うものです。
医薬品医療機器法、GCPに基づく治験と、行政の倫理指針に基づく臨床研究(試験)の最大の違いは、データの信頼性を確保するためのルールが適用されるか否かにあります。厚生労働省によれば、先進医療の成果が治験データとともに、薬事承認申請の際に参考資料として活用される可能性はあるものの、ほとんどが承認申請そのものには使えず、せいぜいPMDAとの薬事戦略相談によって治験のデザインをどう設定するか決めるのに役立つ場合がある、という程度のようです。
橳島 臨床研究をした結果のデータが活かされないというのは、無駄な実験を患者にしたということで、結果として有害事象をもたらさなかったとしても、やったというだけで医学的に不適切なだけでなく、倫理的にも許されないことだという認識が、医学界にも行政にも希薄ですね。
出河 2004年暮れの両大臣合意の後、「混合診療禁止」の適法性を問う訴訟が2006年3月に起こされます。裁判を起こしたのは、神奈川県立がんセンターでLAK療法(がんの免疫療法の一種。一時高度先進医療の対象だったが、神奈川県立がんセンターはその対象医療機関ではなかった)を受けていた患者でした。神奈川県立がんセンターでは、保険適用外のLAK療法を保険診療と併用する、混合診療を行っており、そのことが2005年に「週刊朝日」の報道で明るみに出ます。患者が裁判を起こしたのは、報道後に神奈川県立がんセンターがLAK療法をやめたことがきっかけでした。訴訟の主な争点は、厚生労働省が例外的に認めた特定療養費制度(のちの保険外併用療養費制度)の対象になっていない保険外診療を保険診療と併用したときに、保険診療分にも保険が給付されないという、「混合診療禁止原則」が健康保険法に照らして適法かどうか、という点でした。
一審の東京地裁は患者の訴えを認めましたが、東京高裁、最高裁は国側の主張を認め、混合診療禁止原則の適法性が確定しました。東京高裁、最高裁は、保険で提供する医療について、保険財源の面からの制約や、提供する医療の質(安全性、有効性等)の確保などの観点から、その範囲を限定することはやむを得ず、かつ相当、との判断を示しました。安全性、有効性が確認されていない、未確立の医療の広がりを防ぐというのが、厚生労働省が混合診療を原則禁止にする大義名分の一つで、それを裁判所も認めたことになります。
ただし、これまで繰り返し述べてきたように、厚生労働省は臨床研究を一元的に法の管理下に置こうとはしていませんし、自由診療についてはほぼ野放し状態です。ですから混合診療を認めない理由として、「患者の安全の確保」を持ち出す厚生労働省の論理には矛盾を感じざるをえません。混合診療禁止原則をめぐる裁判でも、原告側はこの矛盾を突くかのように、安全性や有効性が確立していない医療については、「医師法、医療法、薬事法といった他の法令により直接禁止すべき」と主張しました。
橳島 当を得た主張ですね。そこにさらに次にいう「患者申出療養」まで出てくるのですから、矛盾はどんどん拡大しています。患者側に納得いかない気持ちが残るのは当然でしょう。
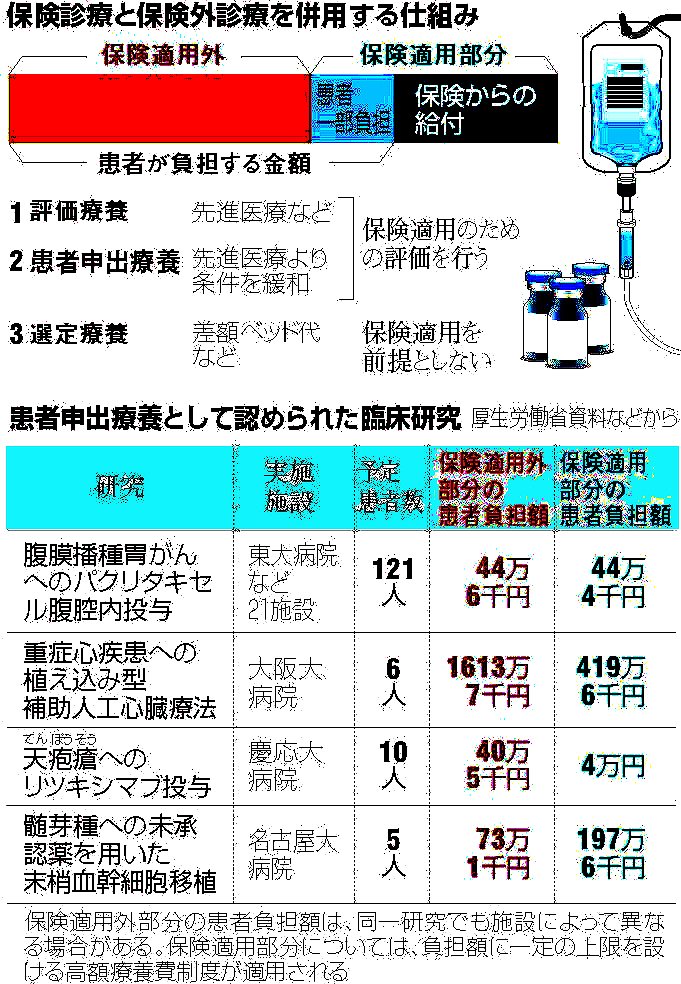
拡大
出河 その「患者申出療養」は2016年4月に導入されました。前述したように、2006年10月に導入された保険外併用療養費制度の下で、保険診療と保険外診療の併用を例外的に認めるものは、保険導入のための評価を行う「評価療養」と、保険導入を前提としない「選定療養」の二つに区分されました。患者申出療養は、評価療養、選定療養に次ぐ第三のカテゴリーとして、健康保険法を改正して制度化されたものです。未承認薬などを用いた保険外診療と保険診療との併用を認めるもので、厚生労働省は「困難な病気と闘う患者の思いに応えるため、先進的な医療について、患者の申出を起点とし、安全性・有効性等を確認しつつ、身近な医療機関で迅速に受けられるようにするもの」と説明しています。
2013年8月22日に開かれた政府の規制改革会議(当時)で、安倍晋三首相は「最新の医療技術を一気に普及するため、利用者の立場に立って、保険診療と保険外診療とを併用しやすくするよう、その範囲を拡大すること、といったテーマに重点をおいて、速やかに方針を取りまとめていただきたい」と諮問した。規制改革会議は同年12月20日にまとめた「『保険診療と保険外診療の併用療養制度』改革の方向性について」と題する文書で、混合診療の禁止原則について、「患者の自己選択権」や「医師の裁量権」を阻害するものであるとの見解を示すとともに、「国民が必要とする診療を保険収載すべきことは当然だが、高価な医薬品、医療機器が次々に開発されるなか、患者や医師のニーズに応えて保険収載の範囲が拡大していくと保険財政の維持が厳しくなりかねない」と、保険財政の維持の観点からも保険診療と保険外診療の併用を認める範囲を拡大すべき、との主張を展開した。そして、翌2014年3月27日の会議で「選択療養制度(仮称)」の創設を提案した。
出河 規制改革会議が提案した選択療養制度は、「患者が自己の選択権によって保険診療と併せて受ける保険外診療(評価療養、選定療養を除く)であって、一定の手続・ルールに基づくもの」とされ、「一定の手続・ルール」として挙げられたのは、①医師が未承認薬などの保険外診療について診療計画書をつくり、書面を用いて必要性とリスクを患者に十分説明し、患者は書面で承諾する、②患者・医師間の診療契約書を保険者に届け出ることで保険給付が行われるようにする――というものでした。厚生労働省が実施医療機関の基準を定め、とりわけ未承認薬などを用いる場合では技術的な妥当性や試験実施計画を審査している先進医療制度とは大きく異なり、国の事前審査なしに医師・患者間の合意だけで未承認薬を保険診療と併用できるようにするという提案でしたから、混合診療の全面解禁を認めるに等しいものであったと思います。
橳島 その通りですね。この提案は日本の公的医療保険制度をなしくずしにする、本当に危険なものであったと思います。
出河 「患者の選択肢の拡大」をうたった規制改革会議の提案は、患者団体の猛反発を受けました。日本難病・疾病団体協議会は2014年4月3日、「安全性や有効性が担保できない自由診療を政府が公認するもので、医療不信を助長しかねない」などと、選択療養制度の導入に反対する要望書を、田村憲久厚生労働相(当時)と規制改革会議の岡素之議長に提出しました。続けて、がん患者団体の有志も、自由診療の放任や、国民皆保険制度の空洞化につながりかねないとして、選択療養の創設に反対する要望書を厚生労働相、規制改革担当相、国会議員に提出しました。患者側から強い反対の声が上がる中、規制改革会議を所管する内閣府と厚生労働省の間で検討された結果まとまったのが「患者申出療養制度」でした。同年6月24日、安倍晋三首相は記者会見で、「医療でも患者本位の新しい制度を導入します」と述べています。

拡大保険外併用療養費制度を見直し、新たな制度を創設することについて「医療でも患者本位の新しい制度を導入します」と記者会見で語る安倍晋三首相=2014年6月24日午後6時39分、首相官邸、越田省吾撮影
患者申出療養制度の手続きは、命にかかわる重い病気の患者がまずかかりつけ医らと話し合い、未承認薬などの使用希望を患者申出療養の窓口機能を持つ病院に伝える。窓口が設置されているのは、質の高い臨床研究を実施できる拠点である「臨床研究中核病院」(現在11施設)と、高度な医療技術の開発・評価・研修を行う役割がある「特定機能病院」(同85施設)で、いずれも医療法に基づき、厚生労働大臣によって個別に承認された病院である。
患者の「申出」があると、臨床研究中核病院が臨床研究の実施計画など、厚生労働省に提出する申請書類を作成する。その際、特定機能病院や患者の身近な医療機関を「協力医療機関」にして申請することができる。申請を受けた厚生労働省は専門家による会議で安全性や有効性、実施計画の妥当性などを審査し、原則6週間で結論を出すことになっている。実施が承認された場合、臨床研究中核病院だけでなく、協力医療機関となっている、特定機能病院や患者の身近な医療機関で未承認薬などを保険診療と併用することができるようになる。
出河 厚生労働省は先進医療の審査をする先進医療会議とは別に、患者申出療養評価会議をつくりました。患者団体の反発によって、先進医療と同じく厚生労働省が個別に審査、承認する仕組みになっていますが、審査に数カ月かかっていた先進医療と異なり、患者申出療養の審査期間は原則6週間とされました。
橳島 ひどいものですね。医師がやりたい未確立の医療を、患者が望むからできるようにするというネーミングがそもそも無責任です。患者が申し出たからやるんですなんて、プロフェッショナル・オートノミーを否定する口実ではないですか。
出河 患者申出療養制度は2015年の健康保険法改正で導入が決まりました。2016年4月の施行後、2017年6月までの約1年間に実施が認められたのは4件です。このうち、第1号となった「腹膜播種胃がんへのパクリタキセル腹腔内投与」は実施医療機関が東京大学医学部附属病院を含む全国21施設に及びますが、あとの3件は臨床研究中核病院単独での実施です。第1号を事例に、患者申出療養制度の問題点を考えてみたいと思います。
腹膜播種胃がんへのパクリタキセル腹腔内投与は、がん細胞が胃の外側の膜を破って、腹腔内に散らばる「腹膜播種」に対し、内服と点滴用の2種類の抗がん剤を用いる療法で、点滴用の抗がん剤は静脈点滴だけでなく、おなかに取り付けたチューブから直接腹腔内にも投与します。腹腔内投与は、静脈点滴だけでは腹腔内のがん細胞まで薬が届きにくいという欠点を補う効果を狙ったものですが、薬事承認されていない用法です。
東大病院を中心とするグループがかねてより臨床研究を重ね、2011年10月~2016年11月に先進医療Bとして保険収載を目指した検証的な臨床研究が行われました。この研究は、患者を腹膜播種の標準治療である「S-1+シスプラチン併用療法(内服薬と静脈点滴薬の併用)」と「S-1+パクリタキセル経静脈・腹腔内併用療法(内服薬と静脈点滴・腹腔内投与の併用)」の二つの療法に無作為に割り付け、二つの投与群で有効性や安全性を比較するものでしたが、両群の生存期間に有意な差が出ませんでした。腹膜播種が進行している患者が腹腔内投与療法群に多く割り付けられたうえ、標準治療を受けた後に試験を辞退し、他院に転院して腹腔内療法を受けた6人の患者も標準治療群(50人)として解析の対象になったことが、生存期間に差が出なかった理由のようです。
仮に、先進医療として行われた臨床研究で腹腔内投与療法の有効性、安全性が証明されていれば、パクリタキセルの用法として腹腔内投与が薬事承認され、保険適用となったはずですが、期待通りの結果を得ることができなかった。しかし、腹腔内投与療法を希望する患者がいることから、新たに創設された患者申出療養制度としての実施を申請し、第1号として実施が認められたわけです。
たまたま先進医療でも実施されたパクリタキセルの腹腔内投与療法が患者申出療養制度の第1号となったことから、この制度が抱える矛盾、問題点が浮き彫りになりました。と言うのは、形の上ではあくまで臨床研究として実施されるのですが、「患者の思いに応える」というのが患者申出療養の趣旨なので、なるべく幅広い患者が参加できるよう、参加基準(被験者の適格基準)が緩和されました。具体的に言えば、先進医療で実施された時は、すでに別の抗がん剤治療を受けたような患者は参加できませんでしたが、患者申出療養ではそうした患者も参加でき、年齢の上限も引き上げられました。条件の悪い患者も参加するので、臨床研究としては良い結果を出すことができなくなる可能性がある。しかも、先進医療として実施されたような、標準治療との比較試験でもありませんから、安全性、有効性を検証するものとはならない。臨床研究としてエビデンスを出せないままいつまでも保険適用が実現しないという事態も予想されます。「保険収載のための評価」という制度の目的が空文化する恐れもないわけではないと思います。
また、患者申出療養制度として実施されたパクリタキセル腹腔内投与療法では、患者の保険外負担は研究の管理料を含めて年間約44万円ですが、第2号となった重症心疾患への植え込み型補助人工心臓療法(大阪大学病院で実施)の保険外負担は約1600万円と極めて高額です。規制改革会議が当初提案した「選択療養」に強く反対した日本難病・疾病団体協議会の森幸子代表理事は私の取材に対し、「安全面はもちろん、費用負担の面でも保険診療と保険外診療の併用をむやみに広げるべきではない」と話しています。
橳島 臨床研究でも通常医療でもないものが行われるようになったということですね。その点だけでも、この制度は根本的に見直す必要があるでしょう。再生医療でも、安全性も効果も定かでない臍帯血細胞のがん患者などへの投与が、臍帯血を売買した業者の摘発で明るみに出て、「詐欺医療だ」と批判を浴びています。患者申出療養もその轍を踏まないように、少なくとも国際標準で認められるレベルの臨床研究として組まなければできないようにするなど、制度を改めていくべきです。

▶︎出河 雅彦(いでがわ・まさひこ)

朝日新聞記者。1960年生まれ。92年朝日新聞社入社。社会部などで医療、介護問題を担当。2002~2013年、編集委員。2013~2016年、青森総局長。医療事故や薬害エイズ事件のほか、有料老人ホームや臨床試験について取材。著書「ルポ 医療事故」(朝日新聞出版)で「科学ジャーナリスト賞2009」受賞。近刊の著書に「混合診療」(医薬経済社)、「ルポ 医療犯罪」(朝日新聞出版)など。
バックナンバー記事一覧へ
医師の治療を「非人道的な行為」と非難した名古屋地裁判決 (2018/02/02)
 ■規制緩和派の「混合診療」拡大要求が矛盾を広げる
■規制緩和派の「混合診療」拡大要求が矛盾を広げる

